
トランスサイレチン型心アミロイドーシス新薬Vutrisiranの臨床試験結果が注目される
新薬Vutrisiranの重要な臨床試験結果
2024年8月30日、アルナイラム社はRNA干渉治療法に基づく新薬Vutrisiranに関する重要な臨床試験の結果を発表しました。この発表は、英国ロンドンで開催された欧州心臓病学会で行われ、心アミロイドーシスという難治性の病気に対する期待が高まる結果となりました。
HELIOS-B試験の概要
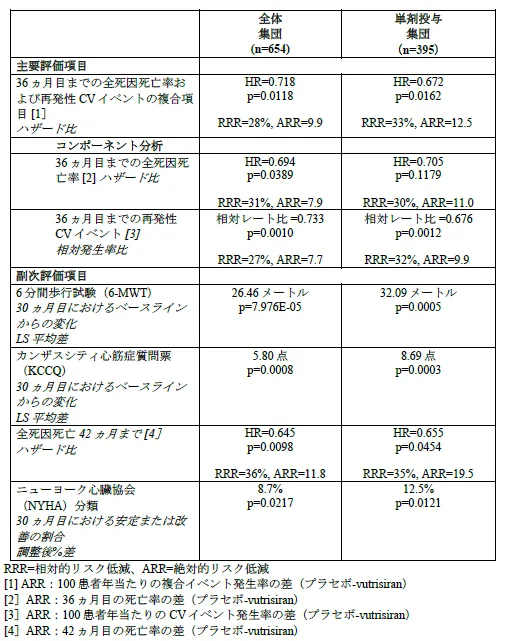
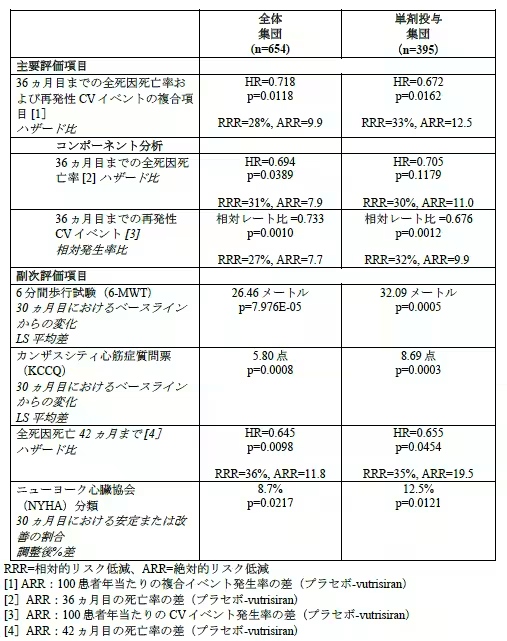
HELIOS-B試験は、トランスサイレチン型心アミロイドーシス(ATTR-CM)患者を対象にした第III相の臨床試験で、主要評価項目として全死因死亡および心血管イベントのリスク低下が確認されました。試験には、655人の患者が無作為に選ばれ、最大36ヶ月の間、Vutrisiranまたはプラセボが投与されました。
結果の詳細
試験結果によると、Vutrisiran投与群はプラセボ群に比べ、全死因死亡および心血管イベントのリスクを大幅に減少させることが示されました。特に、全体の患者集団において、全死因死亡および再発性心血管イベントのリスクは28%減少し、42ヶ月までの評価で死亡リスクが36%も減少しました。また、単剤群においても、同様にリスクが33%減少したことが報告されています。
Vutrisiranの効果は、6分間歩行試験や心臓のバイオマーカー(NT-proBNP)といった複数の臨床指標でも確認されました。特に、早期段階の患者においては、より明確な効果が見られました。
安全性と忍容性
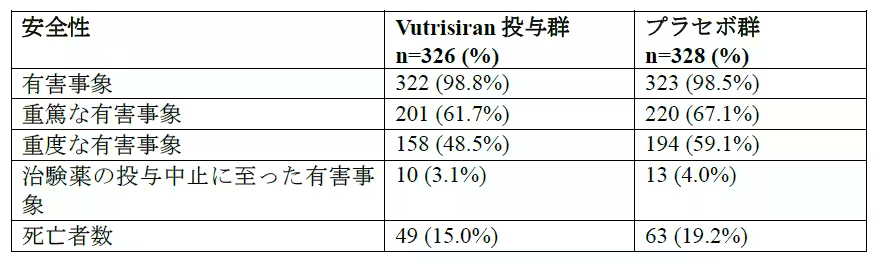
HELIOS-B試験の結果からは、Vutrisiranが既存の治療薬と同等以上の安全性および忍容性を示すことが確認されました。有害事象の発生率は、Vutrisiranとプラセボでほぼ同程度であり、心臓関連の有害事象も同様でした。
医師のコメント
試験責任医師であるロンドン大学のMarianna Fontana医学博士は、「Vutrisiranによる治療が、トランスサイレチン型心アミロイドーシスの治療において大きな進展を示している。特に早期治療が進行を抑え、患者のQOLを向上させる可能性」があるとコメントしています。
今後の展望
アルナイラム社は、Vutrisiranの国際的な承認申請を進めており、FDAへの優先審査も計画されています。これにより、トランスサイレチン型心アミロイドーシスの新しい治療選択肢が患者に提供されることが期待されています。
この研究結果は、慢性的な疾患を抱える多くの患者にとって、重要な希望となるとともに、RNA干渉技術を用いた新たな治療法の可能性を示唆しています。
会社情報
- 会社名
- Alnylam Japan株式会社
- 住所
- 東京都千代田区丸の内1-11-1 パシフィックセンチュリープレイス丸の内11階
- 電話番号
- 03-6629-6200
トピックス(国内(政治・国会・社会・行政))










【記事の利用について】
タイトルと記事文章は、記事のあるページにリンクを張っていただければ、無料で利用できます。
※画像は、利用できませんのでご注意ください。
【リンクついて】
リンクフリーです。