

糖鎖が破骨細胞の形成を抑制するメカニズムを解明し治療応用へ
糖鎖による破骨細胞の形成抑制メカニズムの解明
福岡県北九州市に位置する公立大学法人九州歯科大学の感染分子生物学研究グループが、糖鎖の一種であるβ-glucanの一形態であるcurdlanが破骨細胞の形成を抑制するメカニズムを解明しました。この研究は、特に歯周病などの炎症性骨破壊に対する新たな治療法の開発に貢献することが期待されています。
研究の背景
b-glucanは、真菌や一部の細菌、海藻、穀物に含まれる多糖類で、免疫機能において重要な役割を果たしていることが知られています。しかし、破骨細胞の分化や骨吸収に対するβ-glucanの影響は、今まで十分には解明されていませんでした。これは、破骨細胞が自然免疫細胞から分化するが、複数の免疫受容体を持つため、研究が進んでいなかったためです。
研究の内容と成果
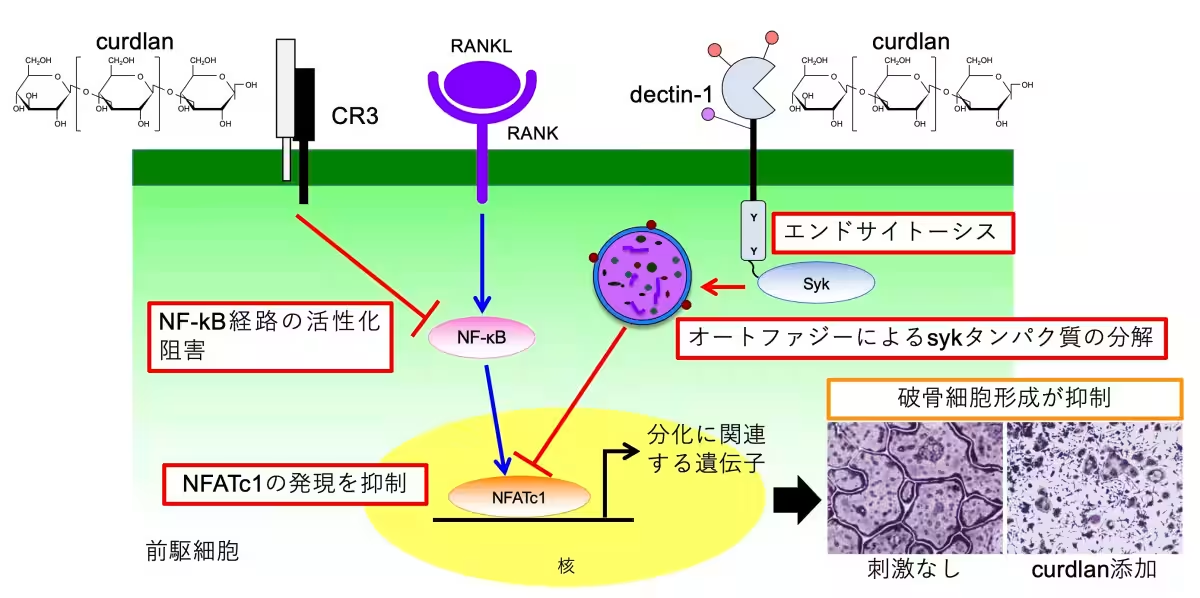
九州歯科大学の古賀絢雅大学院生、有吉渉教授らの研究チームは、curdlanがRAW264.7細胞や骨髄細胞における破骨細胞の分化を抑制することを発見しました。具体的には、この抑制は、curdlanが免疫受容体CR3及びdectin-1に結合することで起こります。
1. CR3との結合:
CurdlanはCR3と結合し、破骨細胞の分化を促進するNF-κBシグナリング経路を抑制します。これにより、破骨細胞の分化に必要な因子NFATc1の発現が抑制されます。
2. dectin-1との結合:
同様に、curdlanはdectin-1と結合し、細胞が外部物質を取り込むエンドサイトーシスと、細胞内のタンパク質を分解するオートファジーの両方を介して、NFATc1の発現に関与するsykタンパク質の分解を促進します。
これらのメカニズムが明らかになったことで、破骨細胞の形成を抑制する新たなアプローチが確認されました。
今後の展望
この研究により、β-glucanが炎症性骨破壊や骨関連疾患に対する新たな治療法としての可能性が示唆されました。特に、糖鎖の結合によって破骨細胞の活性が制御されるメカニズムを掘り下げることで、骨リモデリングの新しい知見が得られるとされています。炎症性疾患の治療における革新的なアプローチとして、今後の研究がますます期待されます。
研究の意義
有吉教授は、本研究が日本学術振興会の支援を受け、多くの協力者の元で完成したことを強調しました。研究には、多様な専門家が関与し、糖鎖の複雑な構造が研究を進める上での難易度となっていたことから、協力体制の重要性が改めて証明されました。
このような研究成果は、将来的に多くの患者に恩恵をもたらす可能性があり、医療現場での応用が待たれます。


会社情報
- 会社名
- 公立大学法人九州歯科大学
- 住所
- 福岡県北九州市小倉北区真鶴二丁目6番1号
- 電話番号
- 093-582-1131
トピックス(科学)









【記事の利用について】
タイトルと記事文章は、記事のあるページにリンクを張っていただければ、無料で利用できます。
※画像は、利用できませんのでご注意ください。
【リンクついて】
リンクフリーです。