
次世代核酸医薬品Chol-HDOが脳疾患治療に希望をもたらす
次世代核酸医薬品Chol-HDOが切り開く新たな治療の扉
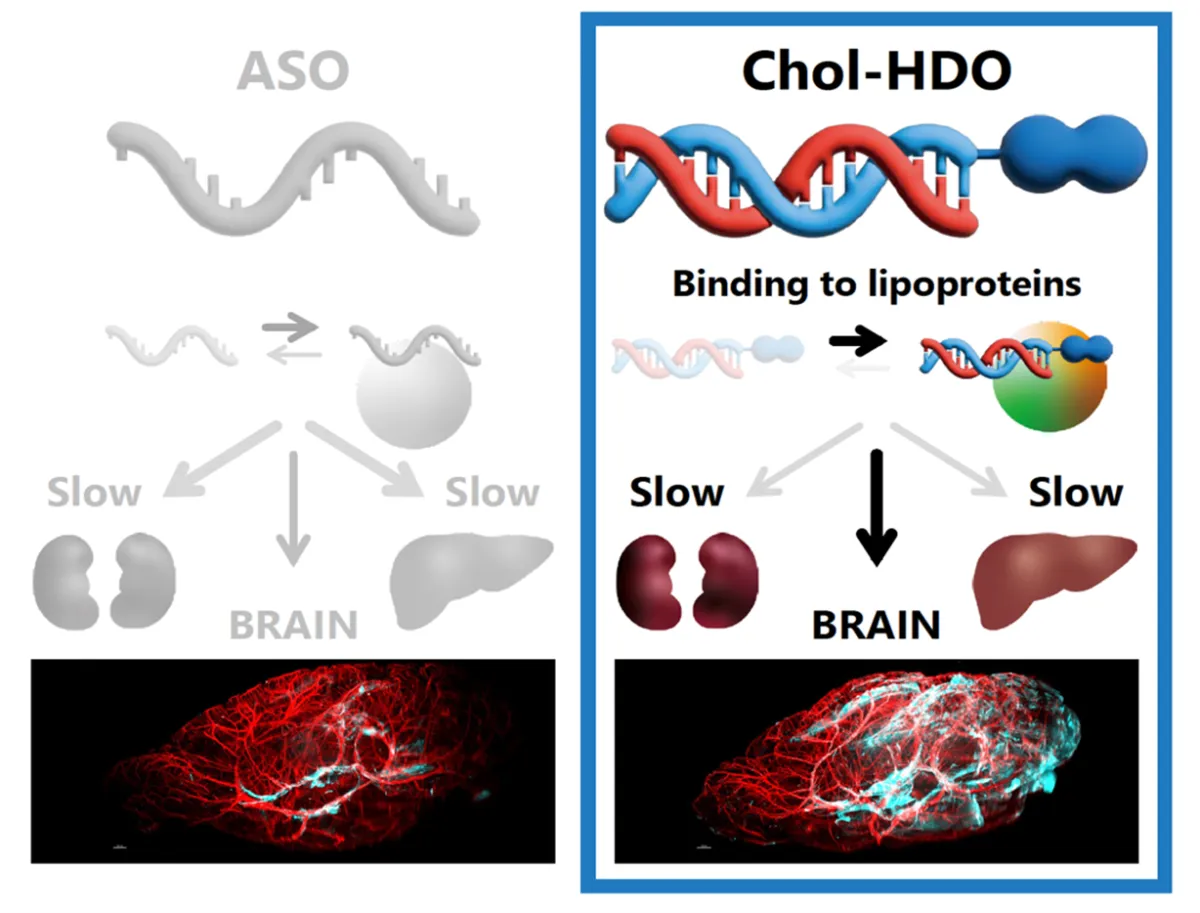
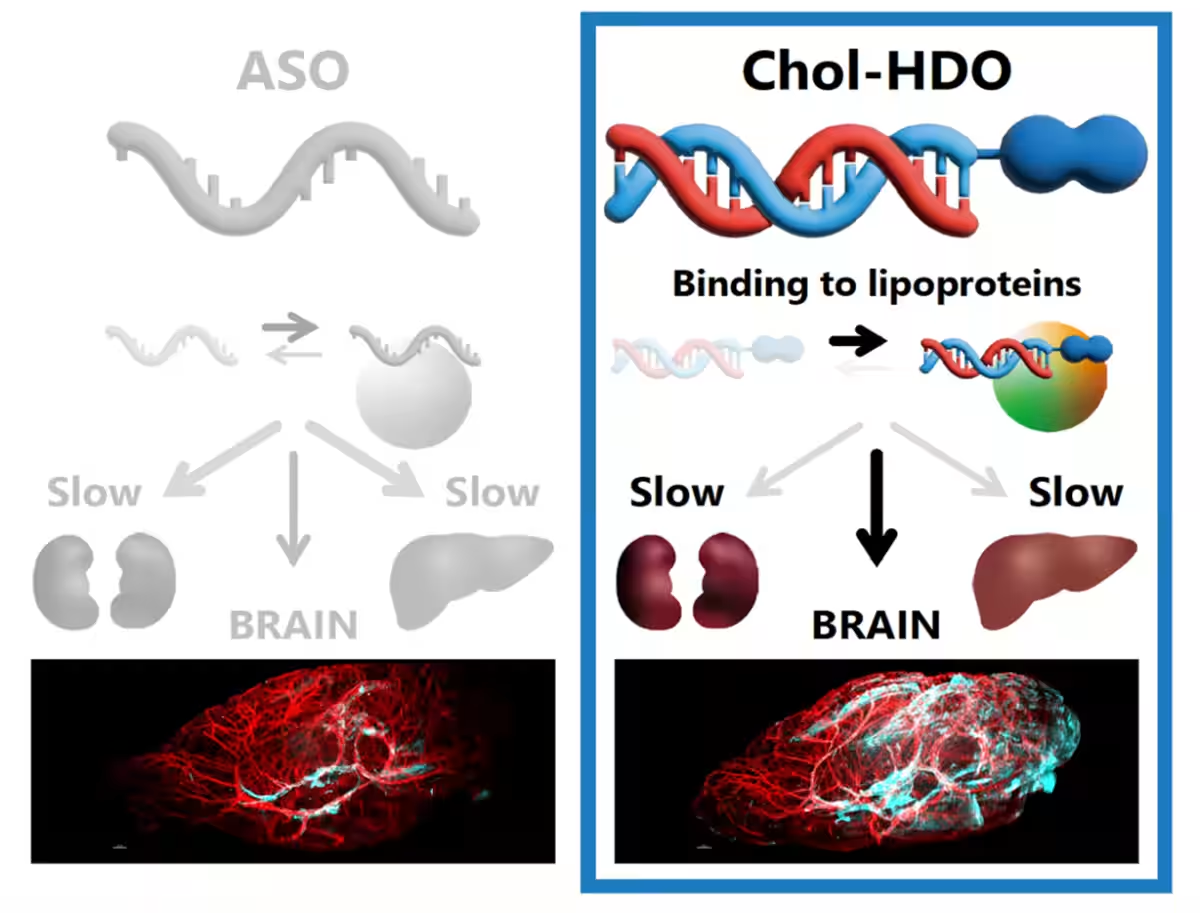
脳をターゲットにした新薬の開発が進んでいます。最近、東京理科大学の研究チームが発表したコレステロール結合ヘテロ二本鎖オリゴヌクレオチド(Chol-HDO)が注目を浴びています。この次世代核酸医薬品は、脳内での薬効が期待され、アルツハイマー病などの難治性脳疾患に対する新たな治療法の可能性を示しています。
研究の背景と目的
厳しい治療の選択肢しかない難病。多くの患者が救済を求めています。ここで登場するのが核酸医薬品です。特に、Chol-HDOのような核酸医薬品は、特定の遺伝子の発現を調整することで、疾患の根本的な治療に寄与する可能性を秘めています。
今回の研究を主導したのは、東京理科大学大学院の吉岡志剛氏と西川元也教授らのチームです。彼らは、Chol-HDOの薬物動態をラットおよびマウスを用いて調査しました。その結果、Chol-HDOが全身の循環血液中に長時間滞留し、これは脳への効率的な薬物送達を可能にすることを確認しました。
Chol-HDOとは何か?
Chol-HDOは、アンチセンスオリゴヌクレオチド(ASO)の一種で、二本鎖の構造を持ち、特定のターゲットRNAと結合します。ASOは、病気を引き起こす特定の遺伝子の発現を抑制することで、難治性疾患に対抗しますが、既往のASOは脳など特定の部位への送達が難しいという課題がありました。これに対し、Chol-HDOはコレステロールと結合させることで、優れた脳移行を実現しています。
研究結果とその意義
研究では、Chol-HDOが脳への投与後に特に高い蓄積を示したことが確認されました。この結果は、Chol-HDOが従来のASOよりも効率的に脳へ送達されることを示唆しています。加えて、Chol-HDOは血漿中での維持が長く、正確なドミナンスを見せることが判明しました。
定量的な測定の結果から、Chol-HDOはASOと比較して、より高い脳内の流入を実現しました。これは、Chol-HDOが脳における遺伝子発現の抑制において、他の治療法よりも優位性を持っていることを示しています。
西川教授もこの成果に自信を示しており、「Chol-HDOの脳移行メカニズムをさらに探求することで、さまざまな核酸医薬品の脳への送達が可能になるでしょう」とコメントしています。
次世代医薬品の開発に向けて
Chol-HDOの研究成果は、今後の核酸医薬品の開発において重要な関門になることが期待されます。特に、慢性疾患や遺伝性疾患に対する特効薬の開発が進む中で、Chol-HDOのような新たな治療法は、患者に新しい希望をもたらすものです。
今後も、研究グループはこの革新的なDDS(ドラッグデリバリーシステム)のメカニズムを解明し、臨床応用に向けたソリューションを提供していく予定です。2025年には、国際学術誌「Journal of Controlled Release」に発表されることも決定されています。
このように、Chol-HDOは脳疾患治療の新たな道を開く期待が寄せられる次世代医薬品です。あなたの周りにも、もしかしたらこの新しい治療法を必要とする方がいるかもしれません。新しい医療の進展がもたらす波に、ぜひ耳を傾けてみてください。
会社情報
- 会社名
- 学校法人東京理科大学
- 住所
- 東京都新宿区神楽坂1-3
- 電話番号
- 03-3260-4271
トピックス(科学)







【記事の利用について】
タイトルと記事文章は、記事のあるページにリンクを張っていただければ、無料で利用できます。
※画像は、利用できませんのでご注意ください。
【リンクついて】
リンクフリーです。