
大日本住友製薬が米国で抗がん剤BBI608の臨床試験結果を発表
BBI608の臨床試験結果発表
大日本住友製薬株式会社が、米国臨床腫瘍学会(ASCO)で抗がん剤「BBI608」の第Ⅰ/Ⅱ相臨床試験の結果を発表しました。これにより、BBI608の新たな治療の可能性が期待されています。
本試験の目的と背景
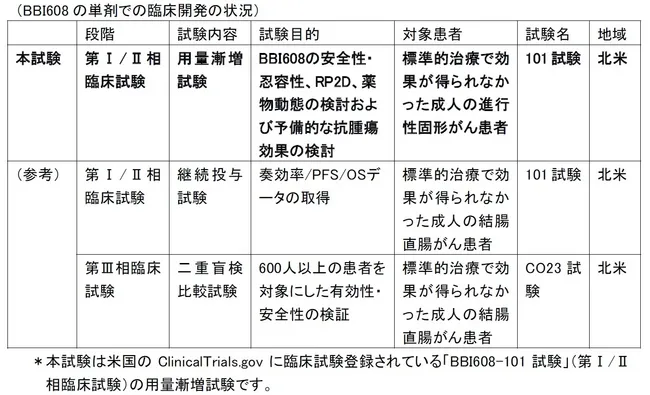
BBI608は、がん幹細胞に効果を示す世界初の抗がん剤として注目されています。この薬剤に関する臨床試験は2009年3月に北米で開始され、主に安全性や忍容性、推奨用量、薬物動態、そして様々ながんに対する抗腫瘍効果を検証することを目的として進められました。
2013年1月からは、結腸直腸がん患者を対象にした第Ⅲ相臨床試験も実施中で、症例数650を目標としています。治療の進展のため、BBI608の可能性に期待が寄せられています。
臨床試験の実施概要
この試験は、標準治療が効果を示さなかった進行性のがん患者41名に対して実施されました。治療対象には、結腸直腸がん、頭頸部がん、胃がんなど多様ながんが含まれています。BBI608は、1日1〜3回、経口投与され、4週間を1サイクルとして投与されました。患者は14のコホートに分けられ、それぞれ異なる投与量が試みられました。
主な成果と副作用
試験結果によると、BBI608の副作用は比較的軽微であり、最も多く見られたのはグレード1〜2の下痢、吐き気、食欲不振、疲労でした。グレード3の重篤な副作用は4件発生しましたが、グレード4はありませんでした。また、最大耐用量は確認されず、血液毒性も認められない結果となりました。最終的に、推奨用量は1日2回、各500mgに設定されました。
予備的な抗腫瘍効果の評価では、病勢コントロール率が65%であり、特に結腸直腸がん患者においては67%に達しました。無増悪生存期間は中央値14週、全生存期間の中央値は47週という成果も報告されています。また、特定のバイオマーカーがポジティブな患者はさらに高い生存期間を示しました。
今後の展望
大日本住友製薬は、自社のBBI608開発を最優先事項とし、がん患者の治療に貢献するために全力を注いでいます。開発の目標として、2015年度に北米市場、2016年度に日本市場での発売を目指しています。新たながん治療の可能性を秘めたBBI608の行く先に注目です。
この情報は2013年6月3日に発表され、過去にも関連情報が公開されています。今後もBBI608の開発が進む中、さらなる成果が期待されます。
会社情報
- 会社名
- 大日本住友製薬株式会社
- 住所
- 大阪府大阪市中央区道修町2-6-8
- 電話番号
- 06-6203-5321
トピックス(エンタメ)










【記事の利用について】
タイトルと記事文章は、記事のあるページにリンクを張っていただければ、無料で利用できます。
※画像は、利用できませんのでご注意ください。
【リンクついて】
リンクフリーです。