
パーキンソン病の新たな治療戦略を示唆するα-シヌクレイン凝集機構の発見
パーキンソン病の新たな治療に向けた革新
順天堂大学大学院医学研究科の研究チームが、パーキンソン病におけるα-シヌクレインの凝集機構を解明し、その結果として新たな治療戦略を示唆する成果を上げました。この研究は、慶應義塾大学、筑波大学、北海道大学との共同研究として進められました。研究成果は、2025年10月14日にEMBO Journal誌で公開されます。
パーキンソン病とは?
パーキンソン病は、運動症状が主な特徴の神経変性疾患で、特に振戦、筋固縮、運動緩慢が問題となります。この病気の病理学的な特徴の一つは、黒質ドーパミン神経の脱落およびレビー小体と呼ばれる異常タンパク質の凝集が観察される点です。レビー小体の主要成分はα-シヌクレインという小型タンパク質で、これが異常に凝集することで病態が進行します。通常、α-シヌクレインは可溶性の単量体として存在しますが、状態が変わるとオリゴマーや線維状の集合体を形成し、細胞に対して毒性を持つとされています。
研究の背景と目的
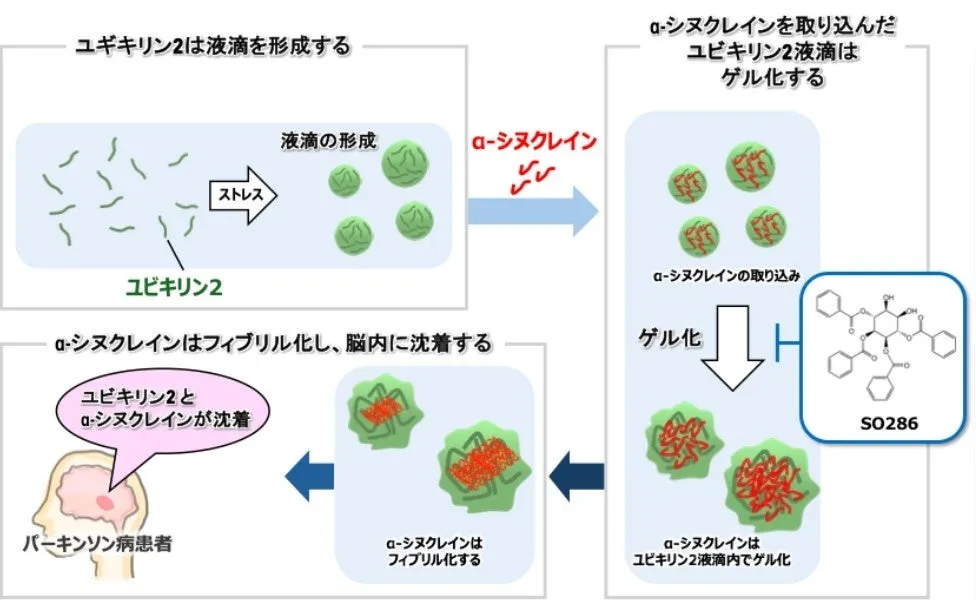
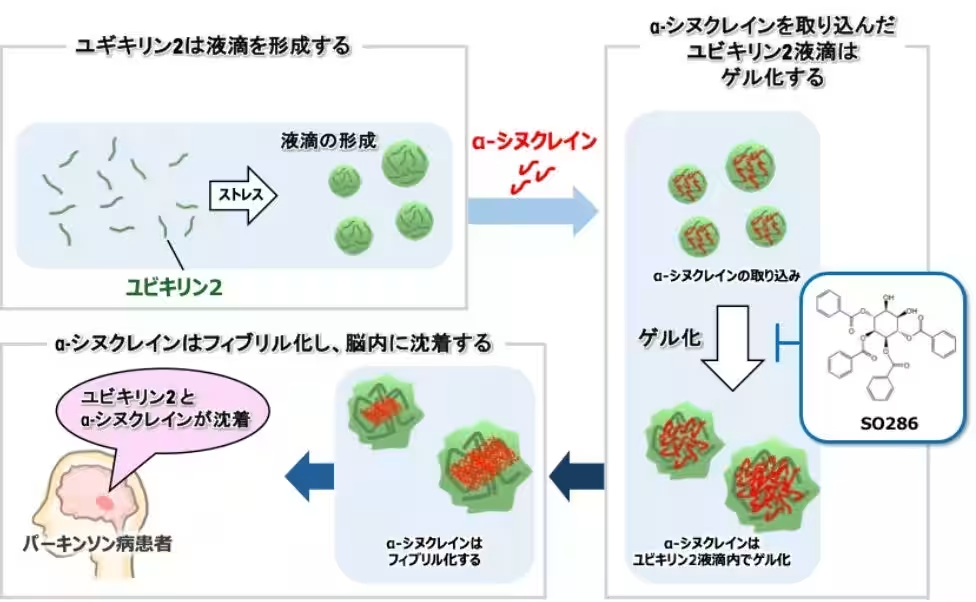
本研究では、α-シヌクレインの凝集を引き起こすメカニズムを解析し、その阻害を目指すことで新たな治療法の開発を目指しています。従来の研究では、液–液相分離がこの凝集に関与している可能性があると考えられていましたが、高濃度のサンプルが必要で、生理的メカニズムとは言い難いものでした。そこで、今回の研究では他の細胞内因子、特にユビキリン2に着目し、その役割を明らかにしました。
ユビキリン2とα-シヌクレインの関係
ユビキリン2の液–液相分離が、α-シヌクレインの凝集を促進することが示されました。具体的には、ユビキリン2の液滴が形成されることで、そこにα-シヌクレインが取り込まれ、相互作用が起こるのです。このプロセスの中で、液滴は時間経過とともに固形化し、最終的に病原性のフィブリルへと変わります。さらに、実際のパーキンソン病患者の脳切片を解析した結果、レビー小体にユビキリン2が存在していることも確認され、このタンパク質が生体内でもα-シヌクレインの凝集に関与している可能性が示唆されました。
新たな治療薬の開発
研究チームは、α-シヌクレインと結合する小分子化合物SO286を発見しました。この化合物はユビキリン2の液–液相分離を制御し、α-シヌクレインとの相互作用を阻害します。その結果、α-シヌクレインの病原性フィブリル化が抑制されることが分かりました。このような知見が得られたことで、ユビキリン2を標的とした新たな神経変性疾患治療法の開発が期待されています。
今後の展望
今回の研究成果は、パーキンソン病だけでなく、アルツハイマー病や他の神経変性疾患の治療法開発にも寄与する可能性があります。研究チームは、SO286を利用した新薬の開発を進めながら、非臨床試験および臨床試験を行い、さらなる成果を目指しています。このように、今回の研究は、神経変性疾患の治療に向けた新たな可能性を広げるものとなっています。
- ---
用語解説
1 α-シヌクレイン:アミノ酸140個からなる疎水性の可溶性タンパク質、神経細胞に多く存在。
2 液–液相分離(LLPS):タンパク質分子同士の相互作用によって生じる現象。
3 液–ゲル/固体への転移:LLPSで形成された液滴が時間とともにゲル化・固化する現象。
4 病原性フィブリル:異常なタンパク質が凝集した、細胞に有害な構造。
会社情報
- 会社名
- 学校法人 順天堂
- 住所
- 東京都文京区本郷2-1-1
- 電話番号
- 03-3813-3111
トピックス(科学)









【記事の利用について】
タイトルと記事文章は、記事のあるページにリンクを張っていただければ、無料で利用できます。
※画像は、利用できませんのでご注意ください。
【リンクついて】
リンクフリーです。