
千葉大学の研究、幹細胞の自衛反応の解明が期待されるがん治療の新たな道
千葉大学の最新研究が明らかにした幹細胞の自衛メカニズム
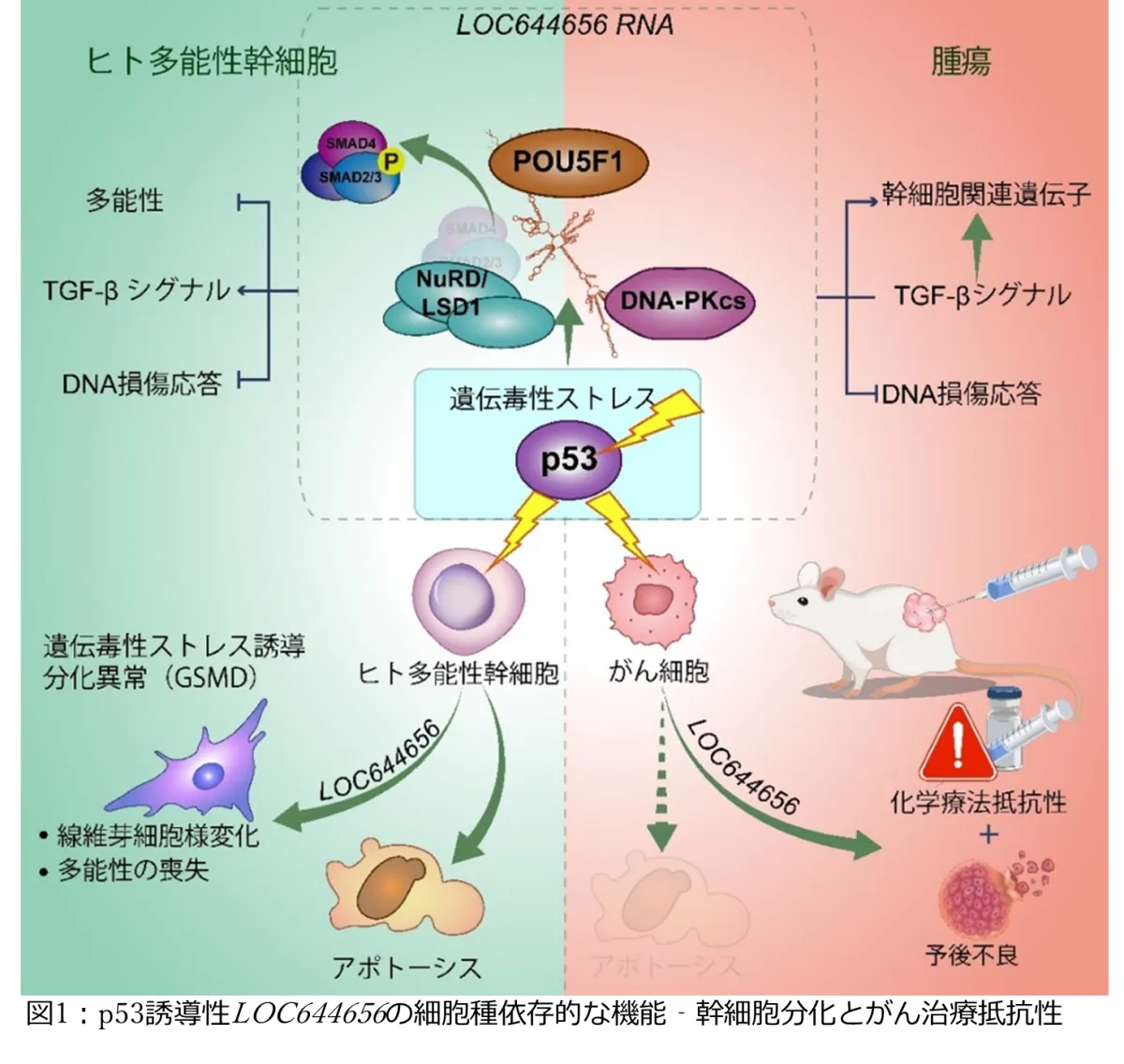
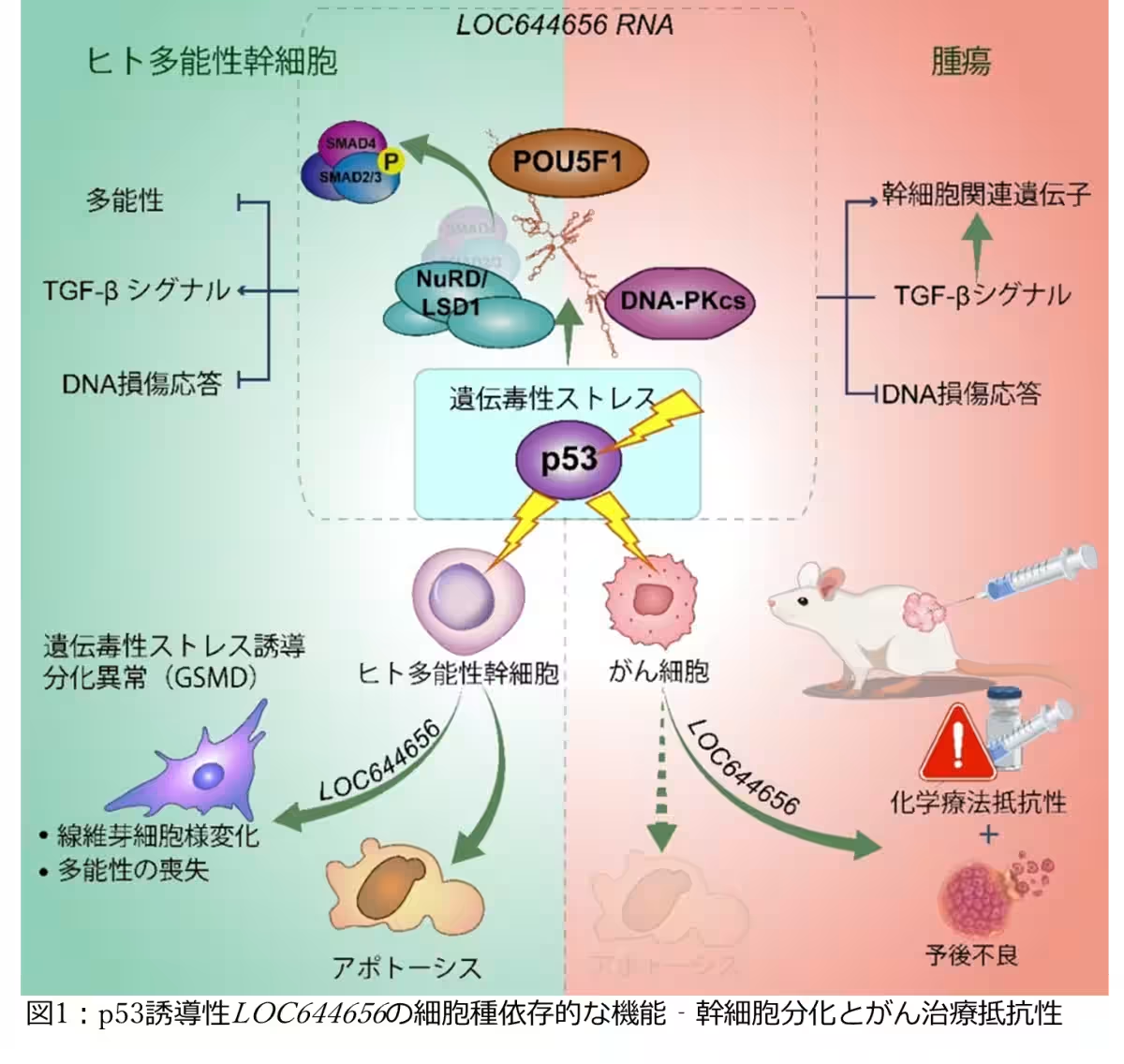
近年、千葉大学大学院医学研究院に所属する田中知明教授をはじめとする研究チームが、がん抑制遺伝子p53によって誘導される長鎖ノンコーディングRNA(lncRNA)であるLOC644656の機能を解明した。この成果は、人間の体内での幹細胞の役割やその反応メカニズムに関する重要な知見を提供し、がん治療における新しい治療法の開発につながる可能性がある。
研究の背景と重要性
幹細胞は、その高い分化能力によってさまざまな細胞に変わりうる特殊な細胞であり、正常な生理機能を維持するために重要な役割を果たしている。しかし、外部からのストレス、特に化学物質や放射線によるDNAダメージが加わると、幹細胞はその能力を失い、分化を選択することで自らの複製を抑制するという「自衛的な」作用を持っている。この現象は、遺伝毒性ストレス誘導性分化異常(GSMD)と呼ばれ、幹細胞が増殖することを防ぎ、生体を保護するメカニズムであるが、その詳細な分子レベルでのメカニズムはこれまで不明だった。
LOC644656の機能と発見されたメカニズム
本研究において、LOC644656は損傷を受けた幹細胞の核内において蓄積し、多能性を維持する因子であるPOU5F1と相互作用することが示された。この相互作用により、LOC644656は幹細胞の未分化状態を抑制し、がん化のリスクを低下させる「ゲノム監視機構」として機能することが分かった。
一方、LOC644656の発現はTGF-βシグナル経路を活性化させ、幹細胞が自己複製能力を喪失し、成熟した細胞に分化する過程を促進する。これは組織の恒常性を維持するための重要な防御機構である。
さらに、LOC644656はDNA損傷修復に関与するタンパク質、DNA-PKcsと直接結合することで、損傷による細胞死(アポトーシス)を抑制する機能を持つことが発見された。このメカニズムは、正常細胞の保護には寄与するが、がん治療においては治療抵抗性の原因にもなるという複雑な特性を示している。
がん治療への新たな希望
研究の結果、LOC644656はがん組織において高い発現が見られ、特に肝臓がんや腎臓がんにおいては予後不良と関連していることが確認された。さらに、実験データにより、LOC644656の誘導はがん細胞に化学療法抵抗性をもたらし、治療効果が低下することが分かった。この発見は、がん治療に新たなアプローチを提案するものである。
未来の展望
この研究は、腫瘍形成および進行に関する新たな医療的知見を示し、LOC644656を標的とした治療法が化学療法抵抗性を克服するための有効な手段となる可能性が考えられる。今後の研究においては、LOC644656を利用したアンチセンスオリゴヌクレオチド療法の実用化が期待される。更に、幹細胞生物学における分化制御メカニズムの理解も進むことが求められている。
まとめ
千葉大学の研究者たちによるこの新たな発見は、がん治療の未来を切り開くものであり、幹細胞における自衛的な反応の解明は、健康を維持するための重要なステップである。
論文情報
この研究成果は、2025年5月23日に国際科学誌Nature Communicationsに掲載されました。タイトルは「p53-inducible lncRNA LOC644656 causes genotoxic stress-induced stem cell maldifferentiation and cancer chemoresistance」です。著者には田中知明氏が含まれ、DOIは10.1038/s41467-025-59886-wです。
会社情報
- 会社名
- 国立大学法人千葉大学
- 住所
- 千葉県千葉市稲毛区弥生町1-33
- 電話番号
- 043-251-1111
トピックス(科学)






【記事の利用について】
タイトルと記事文章は、記事のあるページにリンクを張っていただければ、無料で利用できます。
※画像は、利用できませんのでご注意ください。
【リンクついて】
リンクフリーです。