
κオピオイド受容体の新たなバイアスドシグナリングの解明に成功
κオピオイド受容体の新発見—バイアスドシグナリングの詳細な理解
近年、医薬品開発において新たな視点が求められています。特にオピオイド系鎮痛薬はその効果と同時に、副作用の問題も抱えています。そんな中、明治大学と複数の研究機関が共同で行った研究により、
κオピオイド受容体(KOR)のバイアスドシグナリングに関与する新しい分子スイッチが特定されました。この研究は、クライオ電子顕微鏡単粒子解析(Cryo-EM SPA)、全反射赤外分光法(ATR-FTIR)、分子動力学シミュレーションといった先端技術を駆使して行われました。
研究の背景
Gタンパク質共役型受容体(GPCR)は、細胞外の刺激を体内の多様な応答に転換する重要な膜タンパク質群です。この受容体は医薬品の主要なターゲットでもあり、特にオピオイド受容体は強力な鎮痛効果を持ちながら、「呼吸抑制」や「依存形成」といった副作用が社会的な問題となっています。
特に、κオピオイド受容体(KOR)は、かゆみや慢性痛の治療に有望ですが、その副作用が臨床応用の制約となっていました。そこで、2009年に開発されたナルフラフィンは、その薬物嫌悪を軽減し、新たな治療法として期待されていますが、副作用を完全に抑えることはできていません。
バイアスドシグナリングの重要性
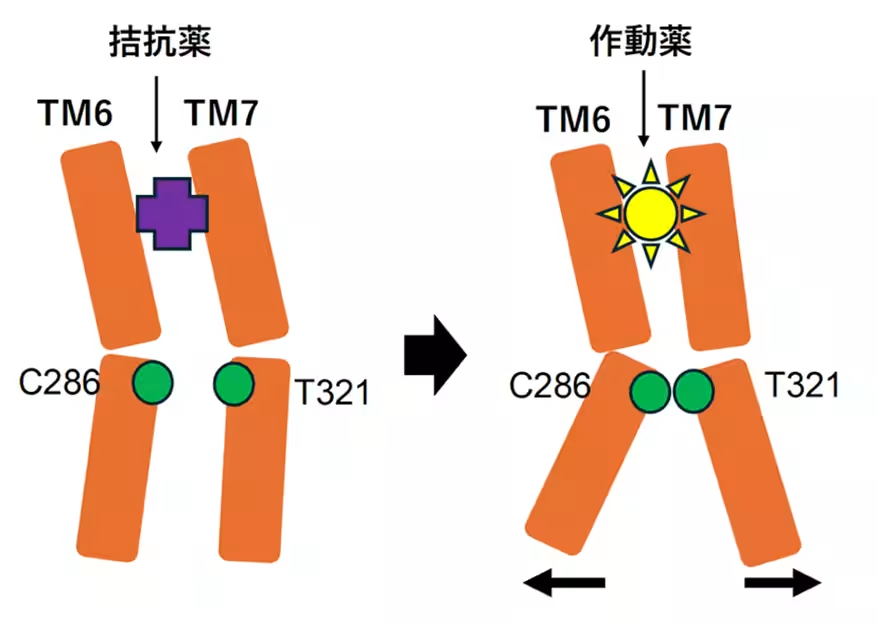
バイアスドシグナリングという現象は、リガンド(分子)が受容体に結合することで異なるシグナル伝達経路が選択的に活性化されることを意味します。この特性を活用することで、副作用を抑えつつ鎮痛効果を持つ新薬の設計が可能になります。研究チームは、KORの二つの作動薬、ナルフラフィンとU-50,488Hを用いて、受容体の活性化機構を詳細に解析しました。
研究成果
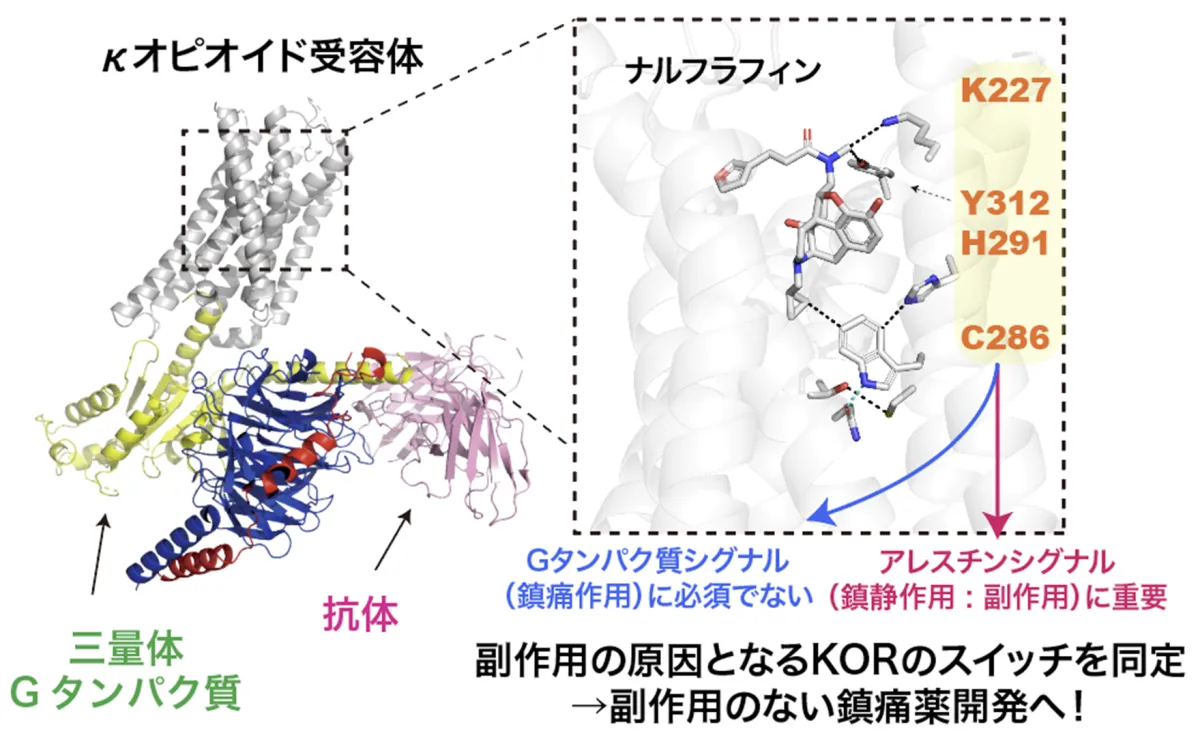
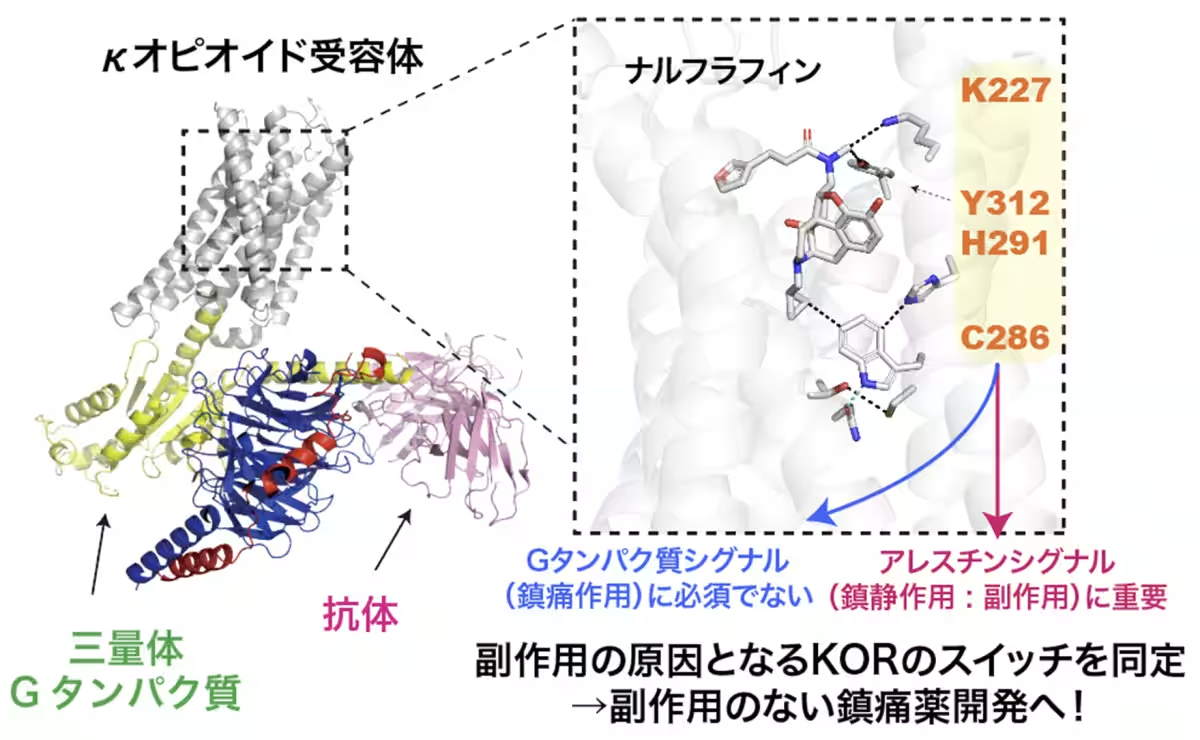
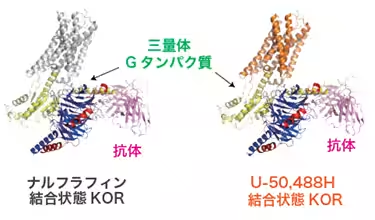
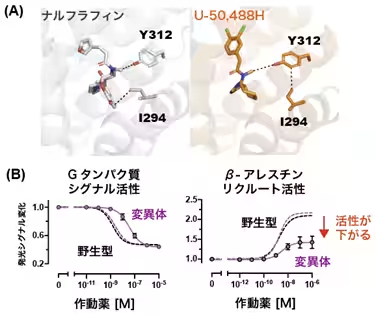
研究の結果、KORにおけるシグナル分岐の始点となるアミノ酸残基(K227、Y312、C286、H291)を特定しました。これにより、良好な作用と副作用の分岐点が明らかになりました。具体的には、Cryo-EM SPAを利用して、これらの作動薬が結合したKOR-Giタンパク質複合体の高解像度構造を明らかにし、それに基づいてシグナル選択性に関与するアミノ酸を同定しました。
また、ATR-FTIRを活用した実験により、薬剤結合に伴う構造変化を捉えることに成功しました。C286やH291といったアミノ酸が、β-アレスチンリクルート活性に重要であることが示唆されています。
今後の展望
今回の発見は、KORを対象とした新薬開発に大きな影響を与えると期待されています。特に、ガイドラインとして利用できる4つのアミノ酸残基をターゲットにした医薬品設計が進めば、副作用を抑えつつ有効な鎮痛薬やかゆみ止め薬の開発が進む見込みです。さらに、今回の研究で確立された手法は他のGPCRファミリーにも応用可能であり、難治性疾患の新たな治療法が開発される期待が寄せられています。
この研究成果は、国際的な専門誌『Nature Communications』に掲載され、今後の薬物開発に向けた一歩となることでしょう。次世代の医薬品が実現する日も、そう遠くないかもしれません。
会社情報
- 会社名
- 学校法人明治大学
- 住所
- 東京都千代田区神田駿河台1-1
- 電話番号
トピックス(科学)









【記事の利用について】
タイトルと記事文章は、記事のあるページにリンクを張っていただければ、無料で利用できます。
※画像は、利用できませんのでご注意ください。
【リンクついて】
リンクフリーです。